Génétique et neurobiologie de C. elegans
Chef d'équipe : Jean-Louis BESSEREAU
C. elegans | synapse | jonction neuromusculaire | récepteurs de l’acétylcholine | vieillissement | génétique | neurobiologie | électrophysiologie optogénétique | microscopie photonique super résolutive | microscopie électronique
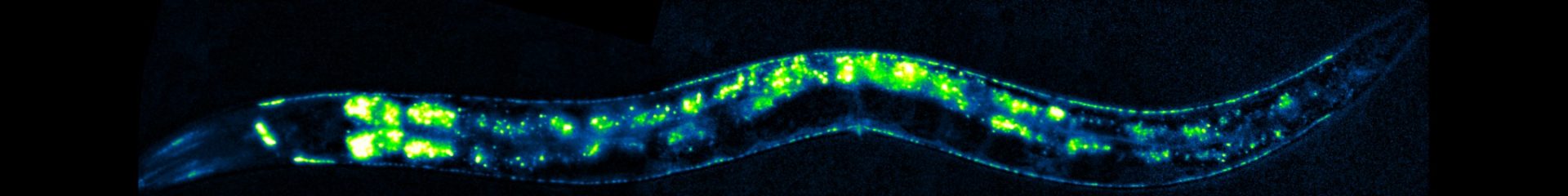
Les synapses neurochimiques sont des nanomachines sophistiquées qui assurent le transfert et le traitement de l’information entre les neurones.
Comme chaque neurone reçoit des milliers d’entrées synaptiques utilisant des neurotransmetteurs différents, sa membrane constitue une mosaïque de microdomaines spécialisés formés par des agrégats de récepteurs positionnés en face des sites de libération du neurotransmetteur. Notre laboratoire étudie les mécanismes cellulaires et moléculaires de la mise en place et du maintien des synapses, avec un intérêt particulier pour les processus qui contrôlent la biogenèse et la localisation des récepteurs des neurotransmetteurs en situations normale et pathologique.
Notre stratégie repose sur la combinaison d’approches de génétique, d’imagerie, d’électrophysiologie et de biochimie utilisant le ver rond Caenorhabditis elegans comme organisme d’expérimentation (pour plus d’information sur ce nématode, voir “Introduction aux Caenorhabditis elegans“). En utilisant la synapse neuromusculaire comme synapse modèle, nous avons identifié plusieurs gènes impliqués dans le positionnement des récepteurs de l’acétylcholine et du GABA. Parmi eux, nous avons mis en évidence un organisateur synaptique antérograde nécessaire à l’assemblage d’échafaudages protéiques extracellulaires piégeant les récepteurs. Nous analysons actuellement l’organisation, la dynamique et la maintenance de ces échafaudages, ainsi que les gènes impliqués dans la biosynthèse et l’adressage de ces récepteurs.
Nos résultats contribuent à une meilleure compréhension de la biologie de la synapse, en contextes physiologique et pathologique. En effet, depuis quelques années, il a été montré dans un nombre croissant de maladies neuropsychiatriques telles que l’autisme, la schizophrénie ou l’épilepsie, qu’il existe des dysfonctionnements synaptiques, faisant émerger le concept de « synaptopathies ». Par ailleurs, la fonction de nombreux gènes identifiés comme des facteurs de susceptibilité de maladies neuropsychiatriques reste inconnue, et il est probable que le paysage mutationnel de ces maladies se complexifie encore avec le foisonnement des données générées par l’accélération du séquençage des génomes de milliers de patients. Nous pensons que la simplicité d’un organisme tel que C. elegans est un outil précieux pour contribuer à démêler cette complexité.
RESTOICH - Ionotropic receptor stoichiometry: pathways and pathology
2022-07-28

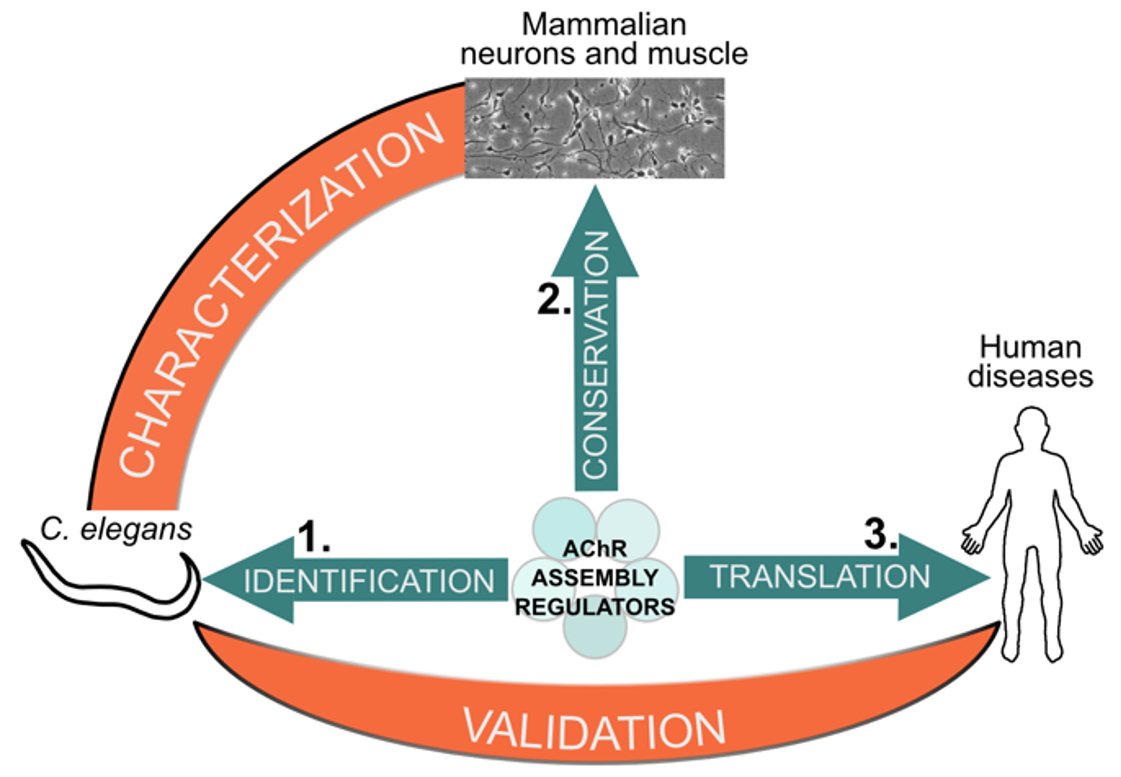
The project of our researcher Manuela D’Alessandro has been selected by ANR JCJC. We will investigate the cellular principles that govern the stoichiometric composition of AChRs, in particular through the identification of novel factors that control AChR composition and their implication in neuromuscular diseases.
The large number of neuronal AChRs subtypes, together with heterogeneity in cellular and subcellular localization, hinder the research on mechanisms controlling receptor stoichiometry using traditional biochemical strategies.
Because AChRs have been extremely conserved during evolution, we will address this question first using the nematode C. elegans as a genetically tractable system, and then in human cells. We will also use the C. elegans model to rapidly validate novel variants in genes controlling AChR assembly from undiagnosed patients and assess their severity.
Genetic control of acetylcholine receptor expression: from new mechanisms to functional genomics
2022-08-31

Our project on genetic control of AChR expression has been selected by AFM. We will try to get a comprehensive genetic landscape of We will perform new-generation screens for decreased amount of AChR at the
C. elegans neuromuscular junction based on direct visualization of the receptors in vivo. Then we will test the functional conservation of
C. elegans genes for AChR biosynthesis in mammals using advanced genome manipulation in mammalian cell lines. Finally we have developed a pipeline to go back from human gene variants to C. elegans and we will assess the pathogenicity of human polymorphisms found in genes required for AChR biosynthesis.
modulators and shed new light on the cell biology of AChR.











